本文基于2025年发表于《Applied Microbiology and Biotechnology》的综述文章(Madhukalya et al., 2025),系统阐述了尼帕病毒的起源、流行病学、遗传多样性、致病机制、诊断方法以及当前和未来的治疗与疫苗研发策略。

一、 概述与流行病学
尼帕病毒(Nipah virus, NiV)是副黏病毒科(Paramyxoviridae)亨尼帕病毒属(Genus Henipavirus)的一种高致死性人畜共患病原体,自然宿主为果蝠(Fruit bats,主要为狐蝠属 Pteropus spp.)。

自1998年在马来西亚首次暴发以来,NiV在孟加拉国、印度、新加坡和菲律宾等地引发了多次区域性疫情。其病死率(Case Fatality Rate, CFR)高达40%-80%,并具备人际传播能力,因此被世界卫生组织列为需要优先关注的病原体。
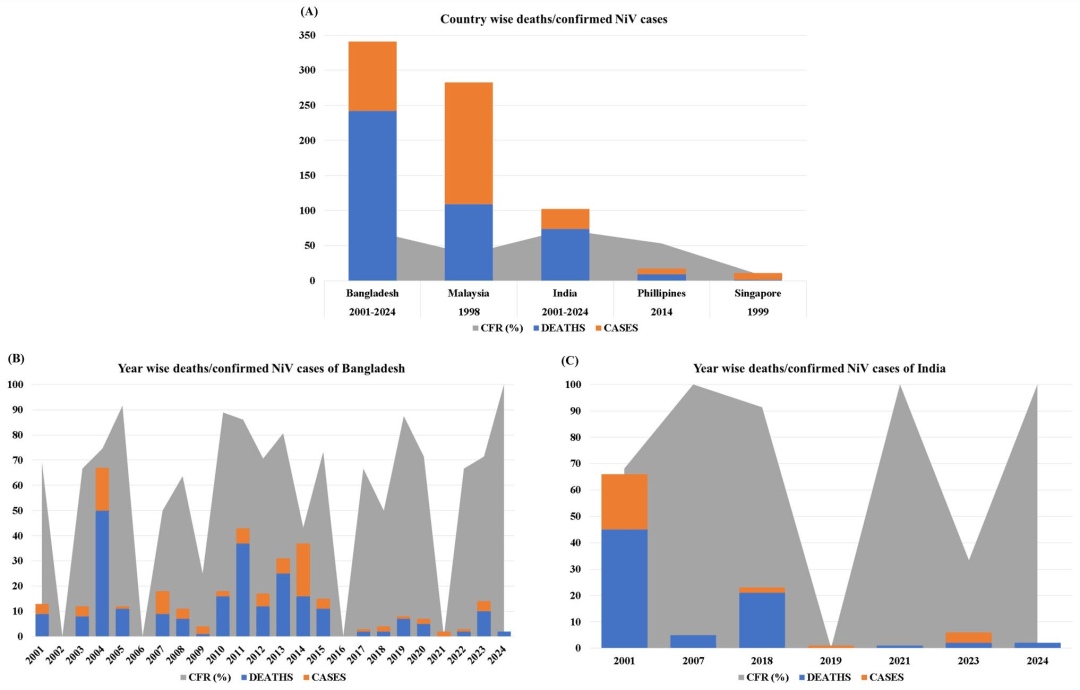
图1:NiV暴发的流行病学趋势,显示确诊病例(橙色)、死亡病例(蓝色)和病死率(CFR)(灰色)。
A 按国家分列的尼帕病毒感染病例和死亡病例分布,其中病死率展示了该病毒在不同国家间感染性的差异。
B 孟加拉国的年度趋势,凸显了自2001年以来反复暴发的情况,以及病例数和病死率随时间的变化。
C 印度的年度数据显示(死亡病例数/确诊病例数),重点指出了喀拉拉邦(2001年、2018年和2023年)的显著暴发。尽管监测和医疗应对措施有所改进,但当地的病死率仍然居高不下。
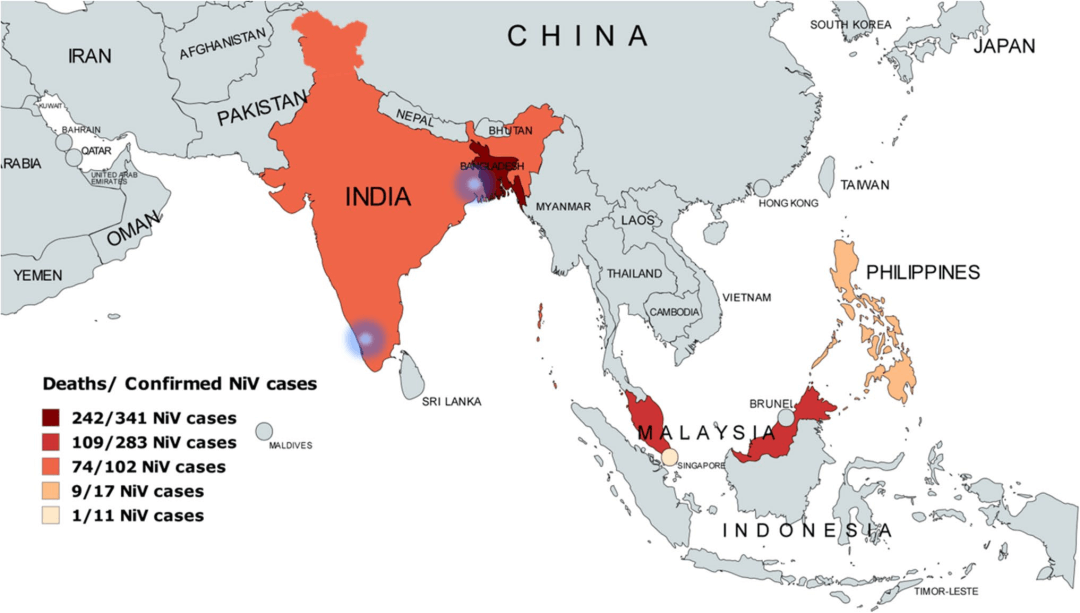
图2:NiV暴发的全球分布,突出显示了确诊病例的累计死亡情况。
该地图展示了受疫情影响的国家,包括马来西亚、孟加拉国、印度、新加坡和菲律宾,并根据报告病例数和死亡人数标明了疫情热点区域。颜色深浅代表疫情的严重程度,颜色越深表示迄今为止记录的病例数最多。印度境内反复暴发疫情的区域(喀拉拉邦和西孟加拉邦)已用蓝色高亮标示。
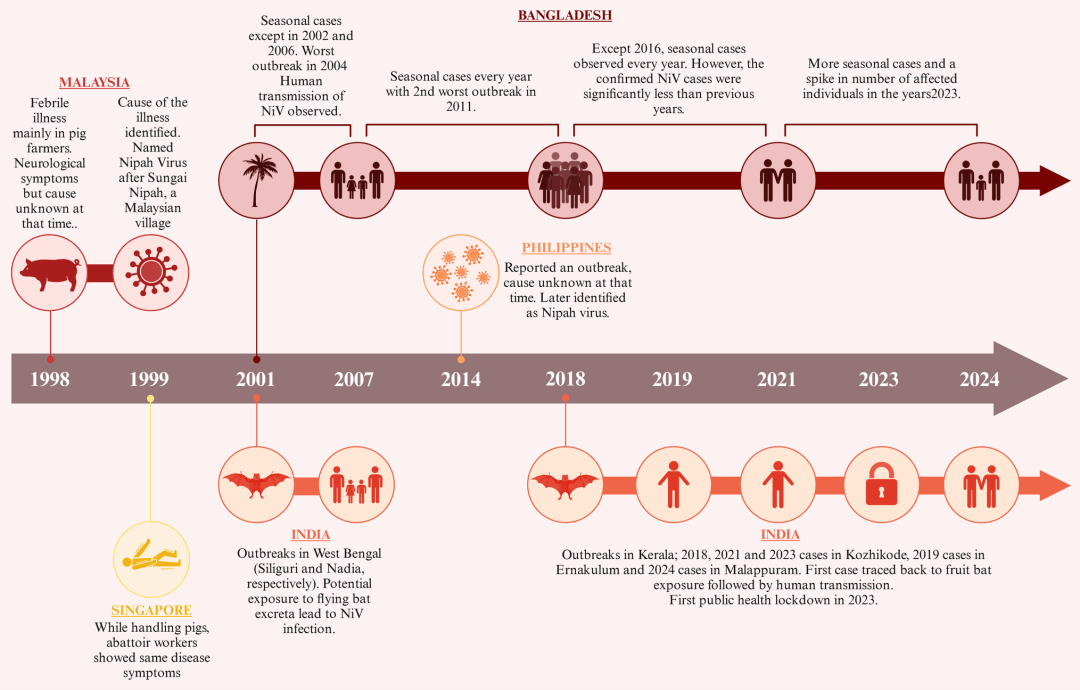
图3:1998年至2024年NiV疫情时间线图
该图展示了主要疫情暴发事件,重点标注了地理位置、病死率及主要传播途径。最早记录的马来西亚疫情(1998–1999年)涉及猪传人途径,而随后的疫情(尤其在孟加拉国和印度)则与蝙蝠直接传人或人际传播相关。值得关注的事件包括:孟加拉国自2001年以来反复出现的疫情,印度喀拉拉邦的多次暴发(2018年、2019年及2023年),以及2024年的近期病例。
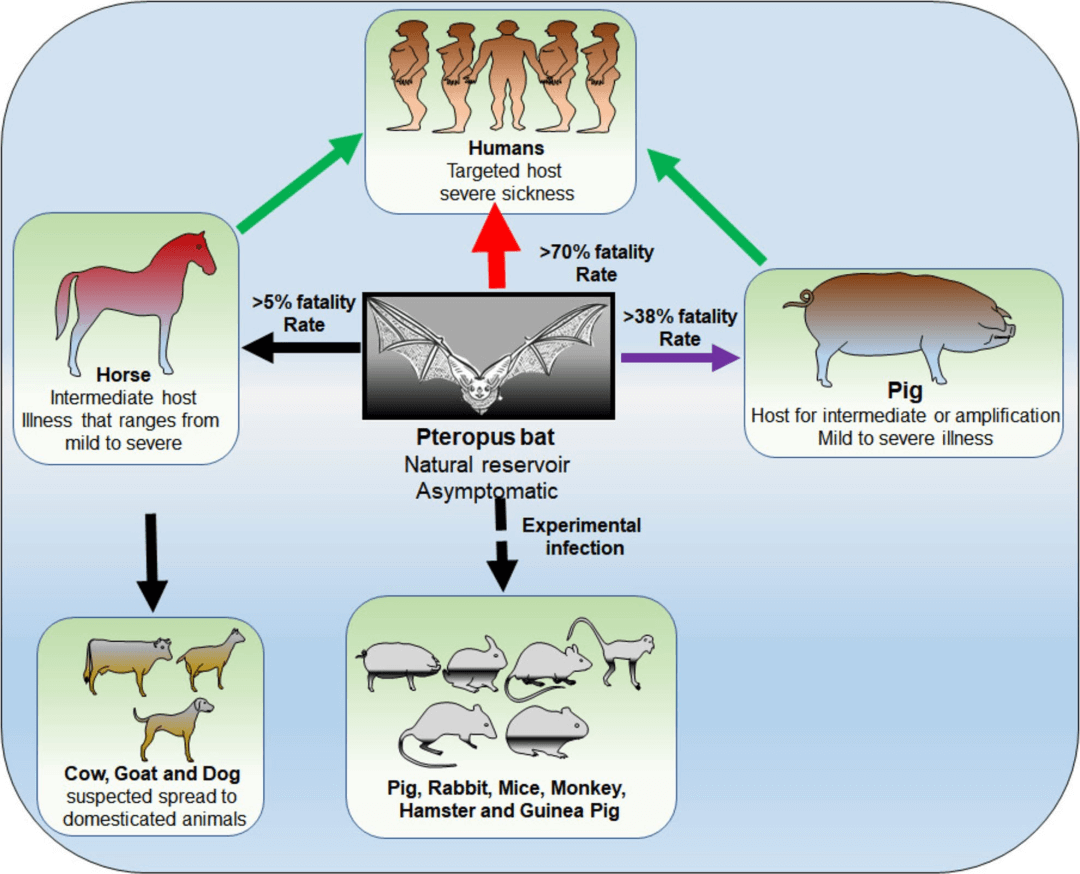
图4:NiV在不同动物模型中传播的复杂动态示意图。
该图形象地描绘了病毒在不同物种间传播所涉及的复杂交互作用。
二、 遗传多样性:NiV-M、NiV-B与NiV-I
根据基因序列差异,已鉴定出两种主要的致病谱系:
- 马来西亚株 (NiV-Malaysia, NiV-M):于1998-1999年首次发现,主要与猪作为中间宿主的传播相关。临床以脑炎(Encephalitis)为主,呼吸道症状少见,病死率约40%。
- 孟加拉国株 (NiV-Bangladesh, NiV-B):于2001年首次发现,常见于孟加拉国和印度的疫情。其特征是更直接的人传人(通过呼吸道飞沫和分泌物)、更高的病死率(~75%),且常伴有严重的急性呼吸道症状。印度的分离株(NiV-India, NiV-I)与NiV-B具有97-99%的基因相似性。
尽管遗传相似性高,但两种谱系在动物模型(如非洲绿猴 African Green Monkeys, AGMs、雪貂 Ferrets)中表现出不同的致病性,NiV-B通常导致更严重的疾病后果。
三、 致病机制与宿主免疫
病毒进入与复制:
-
- 病毒通过附着糖蛋白(Attachment glycoprotein, G蛋白)与宿主细胞表面的受体Ephrin-B2/B3结合。
- 随后,融合蛋白(Fusion protein, F蛋白)发生构象变化,介导病毒与宿主细胞膜的融合。
- 病毒基因组(负链单股RNA)在细胞质中复制和转录,编码6种结构蛋白(核蛋白 Nucleoprotein, N;磷蛋白 Phosphoprotein, P;基质蛋白 Matrix protein, M;融合蛋白 F;附着糖蛋白 G;大聚合酶蛋白 Large polymerase protein, L)和3种辅助蛋白(C, V, W)。
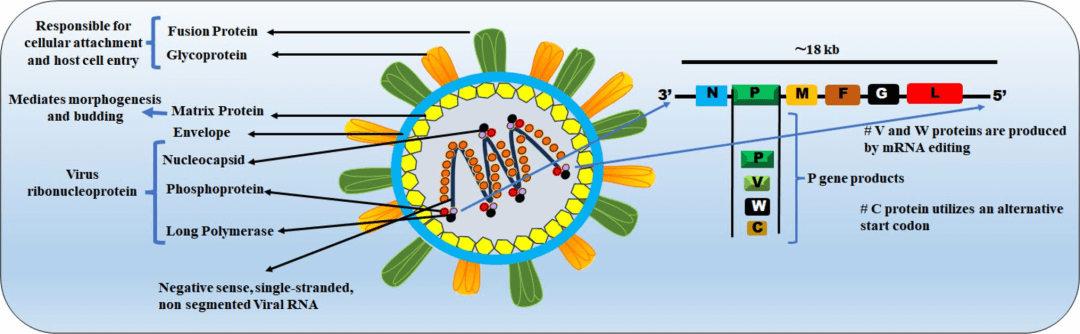
图5:NiV结构与蛋白组成示意图。
此图全面展示了病毒的分子结构,清晰呈现其所有重要结构元件与蛋白组分。
免疫逃逸:
NiV的辅助蛋白(V, W, C)是关键的免疫逃逸因子。它们通过阻断干扰素(Interferon, IFN)信号通路(如抑制信号转导和转录激活因子 STAT1/STAT2 的磷酸化和核转位)、干扰RNA识别受体(如维甲酸诱导基因-I RIG-I / 黑色素瘤分化相关基因5 MDA-5)等方式,有效抑制宿主的先天免疫应答,为病毒复制创造有利环境。
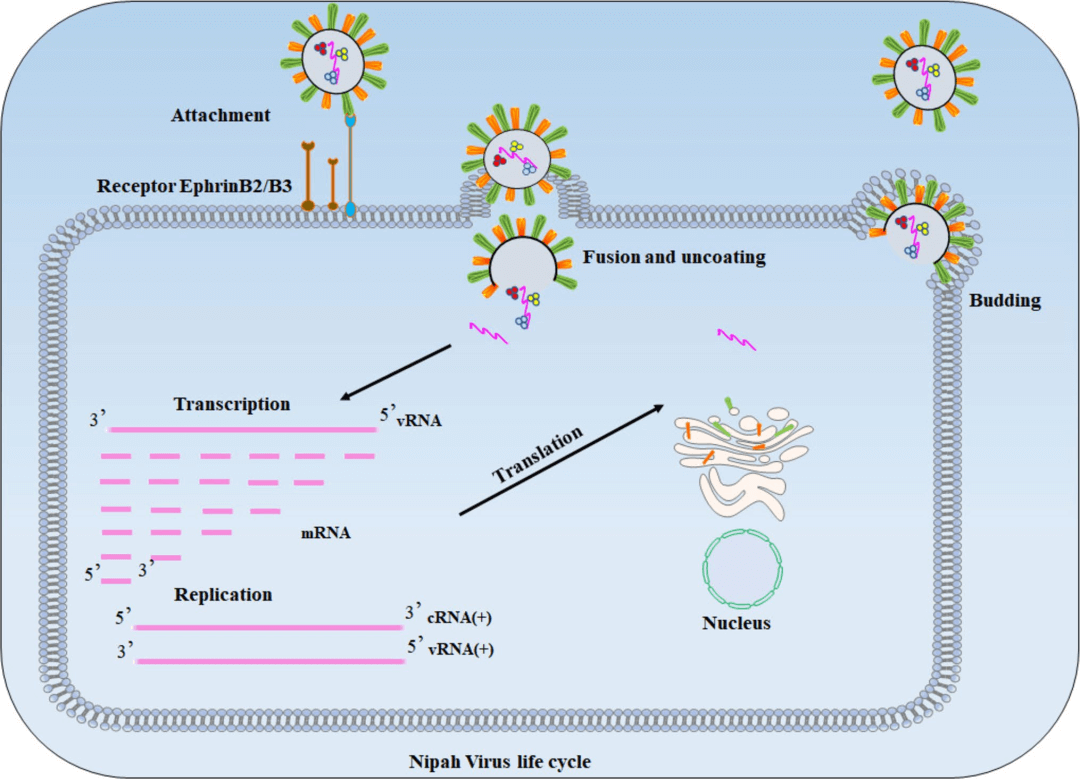
图6:NiV生命周期示意图,包括病毒从进入宿主细胞到释放的所有关键阶段。
该图以图像形式展示了病毒如何进入细胞、复制并离开细胞的过程。
四、 诊断方法
快速准确的诊断对于疫情控制至关重要,现有方法主要包括:
- 分子诊断:
- 实时逆转录聚合酶链反应(Quantitative Reverse Transcription Polymerase Chain Reaction, qRT-PCR):是早期诊断的“金标准”,检测血液、呼吸道拭子、尿液和脑脊液中的病毒RNA。印度已开发出便携式Truenat™ 现场快速检测系统。
- 基于CRISPR的检测技术(如SHERLOCK, Cas12a/13a):新兴的等温扩增技术,具有快速、灵敏、成本低且可在生物安全二级(BSL-2)实验室操作的优势,是未来现场诊断的重要方向。
- 血清学诊断:
- 酶联免疫吸附试验(Enzyme-Linked Immunosorbent Assay, ELISA):用于检测NiV特异性免疫球蛋白M(IgM,急性感染)和免疫球蛋白G(IgG)抗体(恢复期或既往感染),适用于血清流行病学调查。
- 其他方法:
- 免疫组织化学(Immunohistochemistry, IHC):用于对死亡病例的组织样本(如脑、肺)进行确诊。
- 病毒分离(Virus Isolation):因耗时且需在生物安全四级(BSL-4)实验室进行,临床实用性有限。
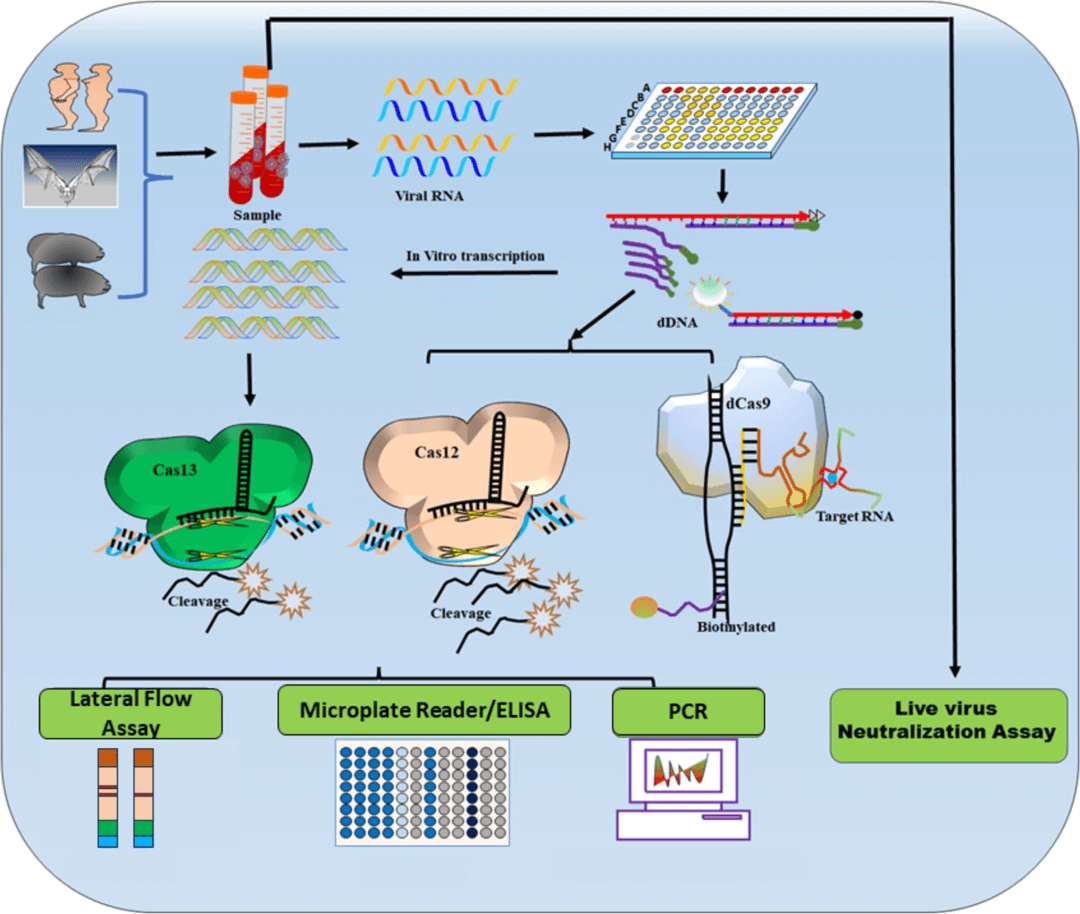
图7:多种技术手段检测尼帕病毒的示意图。
该图展示了多种病毒检测方法及其可视化描述,例如SHERLOCK检测法、侧流层析法、ELISA、PCR以及活病毒中和试验。
五、 治疗策略
目前尚无获批的特异性抗病毒药物或疫苗,治疗以支持疗法为主。
抗病毒药物(均在研):
-
- 瑞德西韦(Remdesivir, GS-5734):一种核苷类似物(Nucleoside analogue),在体外和动物模型中对NiV-B显示出显著疗效,能提供100%保护,是最有前景的候选药物之一。
- 法匹拉韦(Favipiravir, T-705):病毒RNA依赖性RNA聚合酶(RdRp)
-
- 抑制剂,在仓鼠模型中显示出抗病毒活性。
- 利巴韦林(Ribavirin):曾在疫情中经验性使用,但临床证据有限且动物模型效果不佳,副作用显著。
- 新型策略:包括使用植物凝集素(Lectins,如Griffithsin, GRFT) 阻断病毒进入,以及利用缺陷干扰颗粒(Defective Interfering Particles, DIPs) 竞争性抑制病毒复制。
免疫疗法:
单克隆抗体(Monoclonal Antibodies, mAbs) 是目前最具潜力的被动免疫治疗/预防手段。
-
- m102.4:靶向G蛋白的中和抗体,在雪貂和非人灵长类动物模型中,即使在暴露后数天给药仍能提供保护。已完成I期临床试验,显示良好的安全性。
- h5B3.1:靶向F蛋白的中和抗体,能阻止膜融合过程,在动物模型中同样有效。
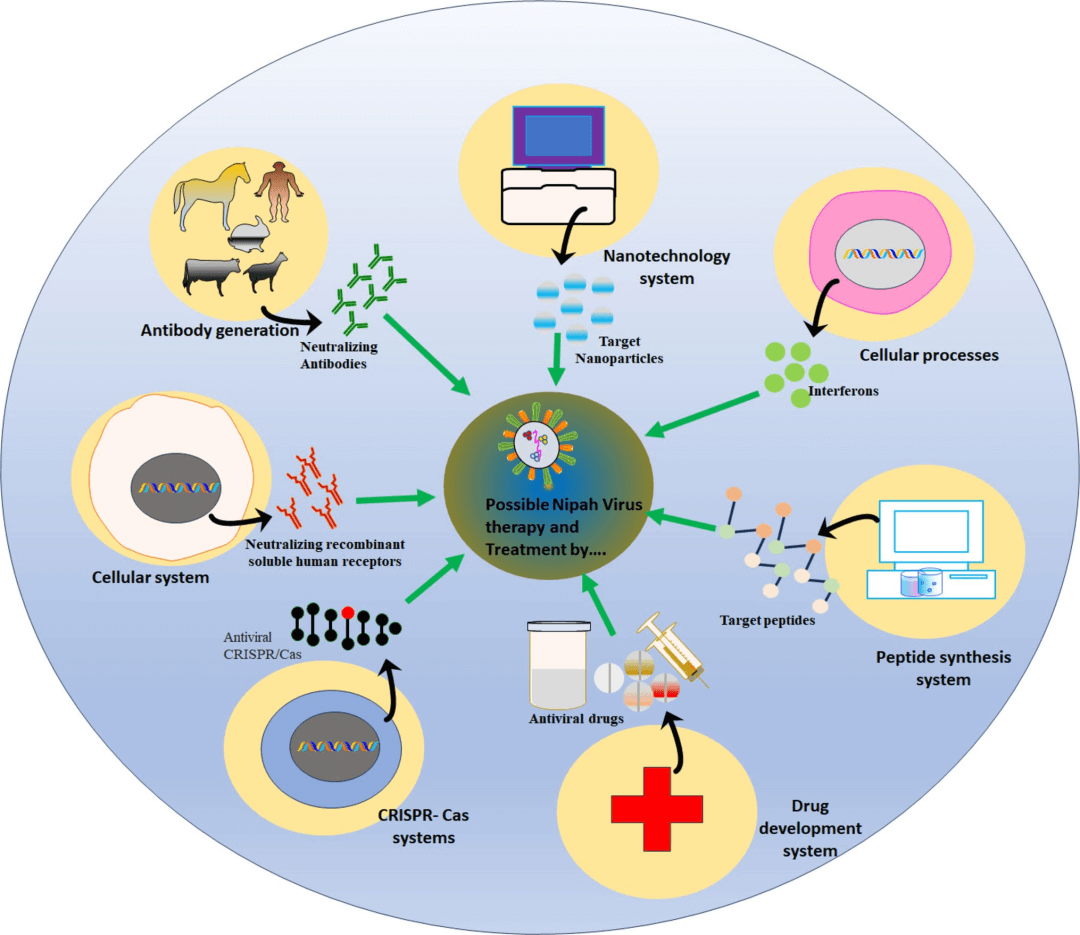
图8:NiV感染的不同治疗途径示意图。
该图展示了包括免疫疗法、纳米疗法和抗病毒药物在内的多种预防病毒感染的复杂方法体系。
六、 疫苗研发进展
多个候选疫苗正处于临床前或临床试验阶段:
- 基于亨德拉病毒sG蛋白的亚单位疫苗:使用亨德拉病毒(Hendra virus, HeV)的可溶性G蛋白(Soluble G, HeV-sG),能对NiV和亨德拉病毒提供交叉保护。这是目前进展最快的疫苗之一,已在马匹中获批使用(Equivac® HeV)。
- 病毒载体疫苗:
- ChAdOx1 NiVB(牛津大学):基于黑猩猩腺病毒载体(Chimpanzee Adenovirus Vector),表达NiV-B的G蛋白,已进入I期临床试验。
- 重组水疱性口炎病毒疫苗(Recombinant Vesicular Stomatitis Virus vaccine, rVSV-NiV):类似已获批的埃博拉疫苗平台,表达NiV的G或F蛋白。
- 信使核糖核酸疫苗(Messenger RNA Vaccine, mRNA Vaccine):
- mRNA-1215(Moderna/美国国家过敏和传染病研究所 NIAID):编码NiV-M的稳定预融合F蛋白,已进入I期临床试验,代表了最新的疫苗技术平台。
- 其他平台:包括病毒样颗粒(Virus-Like Particle, VLP)疫苗、重组麻疹病毒(Recombinant Measles Virus, rMV)载体疫苗等,均在动物模型中显示出免疫原性(Immunogenicity)和保护效力。
七、 挑战与展望
- 研究挑战:NiV被列为BSL-4病原体,限制了广泛研究;全球病例数较少,给传统III期临床试验的组织带来困难。
- 未来威胁:尽管当前人际传播效率有限,但病毒RNA依赖的RNA聚合酶具有高突变率,存在未来出现高传染性、低病死率新变种的风险,可能引发更大规模的疫情。
- 行动呼吁:鉴于NiV的高致死性和大流行潜力,国际社会需持续投入资源,加强基础研究、诊断工具开发、治疗药物和疫苗的研发,并将其纳入全球大流行防范议程的核心。
https://doi.org/10.1007/s00253-025-13474-6
补充:
2026年1月26日中国科学院武汉病毒研究所发文称:
近期研究所肖庚富/张磊砢研究员团队、单超研究员团队联合上海药物研究所、旺山旺水生物医药股份有限公司胡天文博士在期刊《EmergingMicrobes&Infections》发表的重要研究成果,证实口服核苷类药物VV116对尼帕病毒具有显著的抗病毒活性。
VV116不仅可作为医护人员、实验室工作者等高危人群的预防性用药,更可为应对当下和未来的尼帕病毒疫情提供了一个现成的药物选择。
VV116是一款具有广谱抗病毒潜力的口服核苷类RNA依赖性RNA聚合酶抑制剂。其片剂已在中国(商品名:民得维®)和乌兹别克斯坦(商品名:Mindvy®)获批上市,用于治疗新冠病毒感染。

近期,印度西孟加拉邦尼帕病毒卷土重来,当地确认了数例感染病例,尽管感染数量暂时不大,但是由于NiV是一种具有严重公共卫生威胁的新发传染病病原体,致死率高达40%-80%,且仍无获批的针对性医疗对策,因此需要提高警惕,做好防范与筛查,防止疫情爆发带来严重后果。
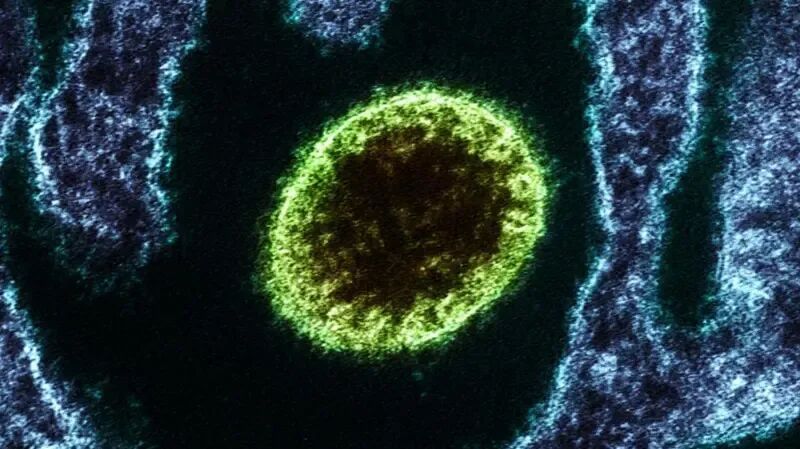
通过电子显微镜观察到的尼帕病毒(呈绿色)。
尼帕病毒与新冠病毒一样,也是一种RNA病毒,因此可以通过逆转录+荧光定量PCR检测的方式进行快速筛查。
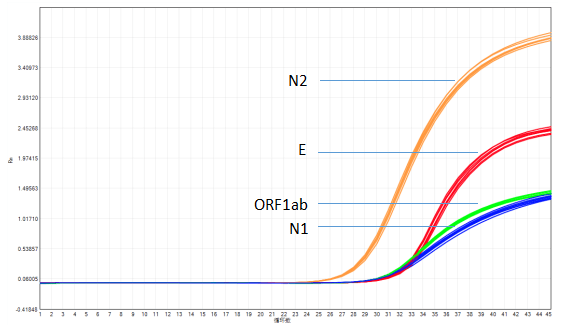
东盛生物的RNA病毒核酸检测核心原料:一步法RT-qPCR试剂已成功验证对于新冠病毒具有极高的灵敏度和检出率,可以作为尼帕病毒核酸检测试剂盒的理想原料。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
订购咨询
广州东盛生物科技有限公司
📧 sales@gdsbio.com
📞 020-87791356
🌐 www.gdsbio.cn
