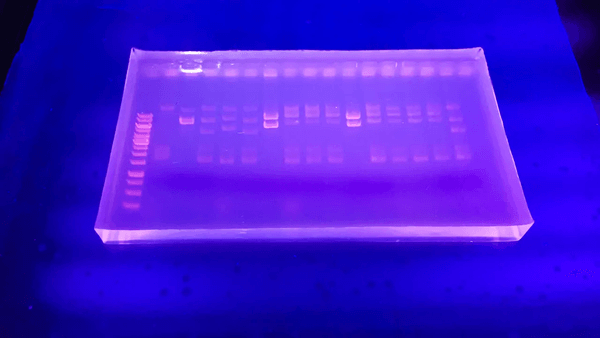
DNA 电泳是分子生物学实验的“基本功”,几乎所有科研人员都绕不开。虽然操作看似简单,但原理与细节不少,一旦忽视就可能导致条带模糊、结果失真,甚至实验“全军覆没”。今天我们来拆解几个常见的误区,从理论到实践,帮你真正理解电泳原理,少走弯路。
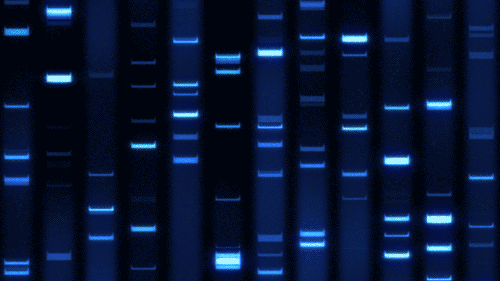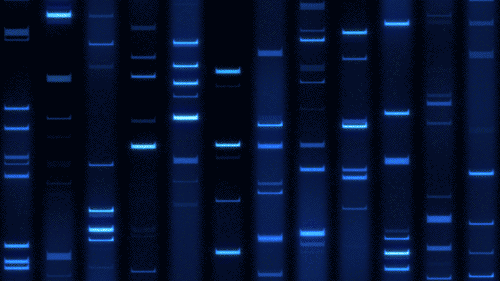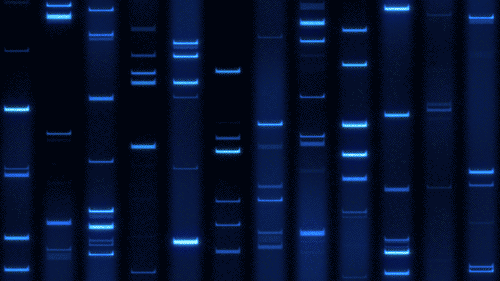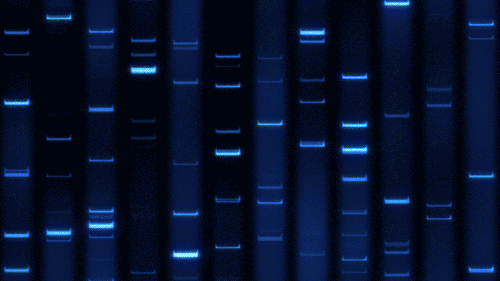
⚡️ 原理回顾:DNA 为什么能“跑起来”?
DNA电泳过程示意图
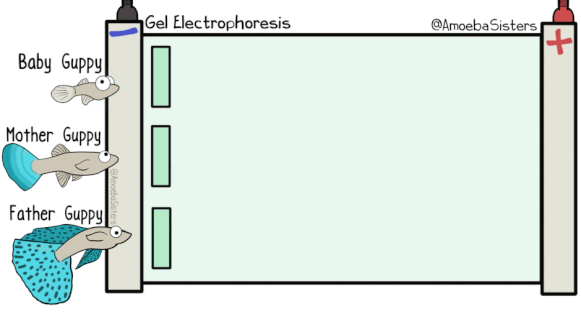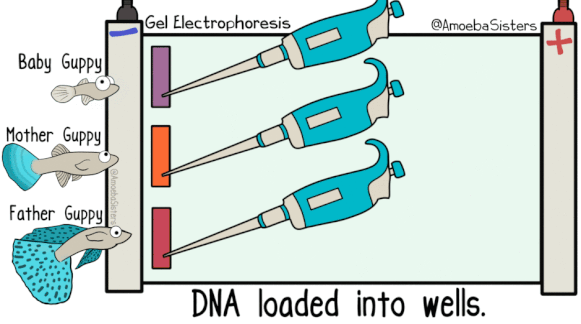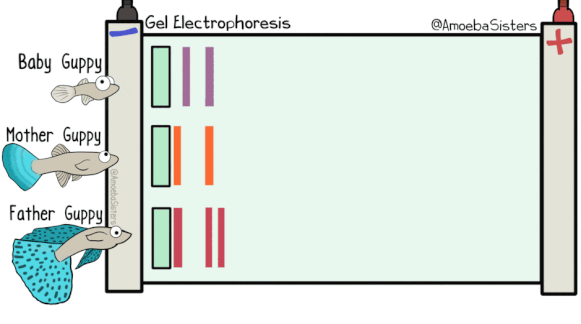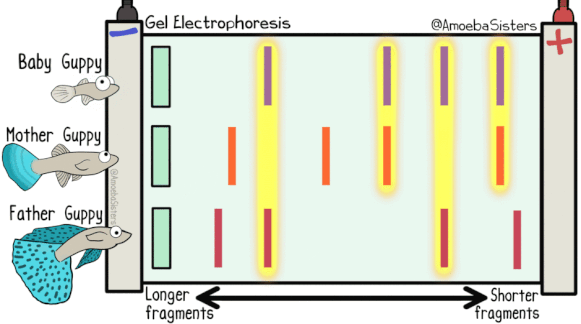
DNA 电泳依赖的是 电场驱动:带负电荷的 DNA 分子在电场中向正极迁移。迁移速度主要受以下因素影响:
分子大小:小分子 DNA 在凝胶孔隙中阻力小,迁移更快。
琼脂糖浓度:浓度越高,凝胶网孔越密,分辨小分子的能力更强。
电压与缓冲液:电压过高会导致发热,缓冲液离子浓度不当会影响电流与分辨率。
核酸构象:线性 DNA、超螺旋质粒、开环质粒迁移速度各不相同,超螺旋质粒 > 线性 DNA > 开环质粒。
超螺旋质粒(Supercoiled DNA)构象紧密,分子呈现高度压缩状态。在凝胶孔隙中受到的阻力最小 → 迁移速度最快。
线性 DNA(Linear DNA)构象伸展,迁移速度主要取决于分子大小。一般情况下,速度介于超螺旋和开环之间。
开环质粒(Nicked/Relaxed Circular DNA)因单链切口导致环形松弛,构象最“蓬松”。在凝胶中阻力最大 → 迁移速度最慢。
理解这些原理,才能真正避免实验中“看不懂”的现象。
🚩 常见误区一:琼脂糖浓度随意配
琼脂糖是从海藻中提取的一种线性聚合物,加热溶解后再冷却会形成具有网状结构的凝胶。这个网络就像一个个筛孔。

琼脂糖浓度对迁移率和分辨率的具体影响:
a. 对迁移率(Mobility)的影响
对于同一大小的DNA片段,琼脂糖浓度越高,其受到的阻力越大,迁移速度越慢。反之,浓度越低,迁移越快。
因此,在不同浓度的凝胶上,同一个DNA片段的迁移位置是不同的,不能直接比较。
b. 对分辨率(Resolution)的影响
分辨率是指将大小相近的DNA片段分离开的能力。这是琼脂糖浓度最重要的影响。
- 低浓度凝胶(如0.5%-0.8%):
筛孔大,允许大片段DNA(>10 kb)有效分离。小片段DNA跑得飞快,但彼此之间难以分开,会挤在一起形成模糊的一条带。
优点:适合分离大片段DNA。
缺点:凝胶非常脆弱柔软,容易破损。
- 中等浓度凝胶(如0.8%-2.0%):
这是最常用的范围,提供了一个良好的平衡,能有效分离0.5 kb - 10 kb范围内的DNA片段,足以满足大多数常规实验(如质粒、PCR产物、酶切产物的鉴定)。
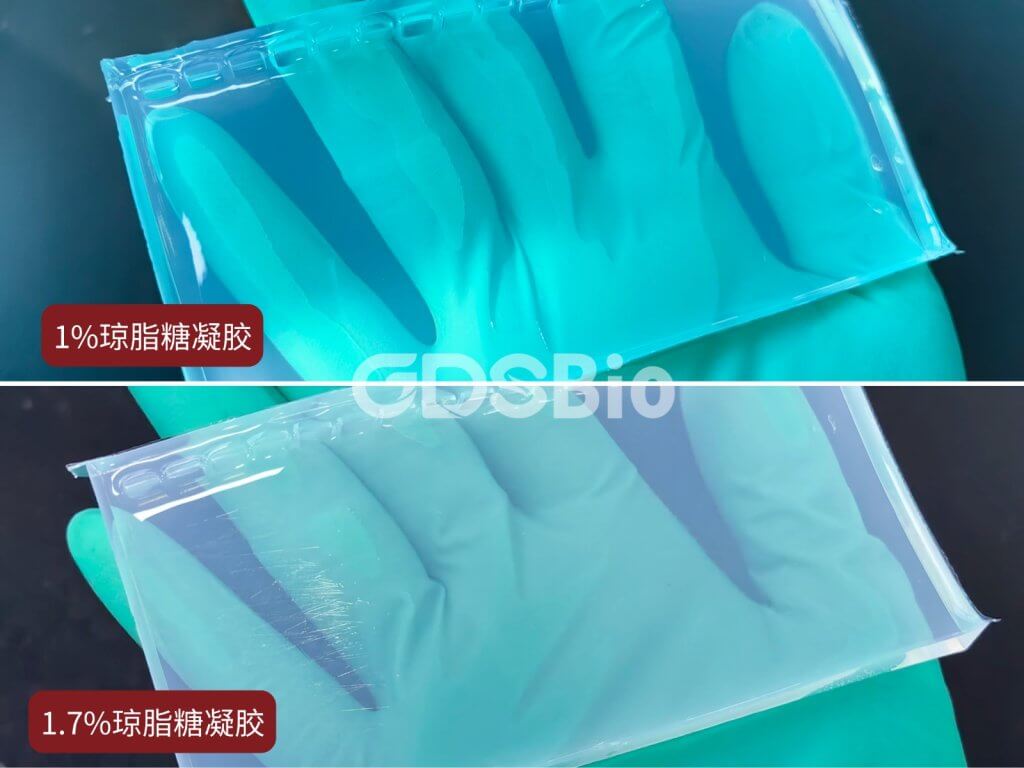
1%与1.7%琼脂糖凝胶外观对比

1%与1.7%琼脂糖凝胶分辨率对比
M1: 100bp Ladder; M2: DS2000; M3: DS5000; M4: 1kb Ladder
- 高浓度凝胶(如2%-3%):
筛孔小,能很好地分离小片段DNA(<1 kb),甚至能分辨出几十个碱基对的差异。大片段DNA则几乎无法移动,停留在加样孔附近。
优点:对小片段DNA分辨率极高。
缺点:凝胶脆性大,易碎。
👉 浓度错误直接导致分辨率下降,大片段跑不动,小片段跑成一团。
🚩 常见误区二:电压越高越好
琼脂糖凝胶电泳里电压是个很关键的因素,直接影响到DNA/RNA 迁移速度、条带清晰度和分离效果。
1. 电压与迁移速度
-
高电压 → 分子迁移更快:电场力更强,带负电的核酸分子快速向正极移动。
-
低电压 → 迁移较慢:分离过程更温和,条带移动较慢。
2. 电压与分辨率
-
低电压(常用 4–6 V/cm):迁移慢,但小片段与大片段的分离效果更好,分辨率高,适合区分相邻大小的条带。
-
高电压(>10 V/cm):条带跑得快,但容易拉宽、拖尾,分辨率下降。

4V/cm、7V/cm、9V/cm电压分辨率对比
3. 电压与热效应
-
高电压 → 产生焦耳热:缓冲液升温,凝胶变软甚至熔化,导致条带弯曲(smiling bands,笑脸效应)。
-
散热不足:DNA 迁移速率不均匀,上下条带弯曲,DNA降解,影响结果准确性。
-
解决办法:降低电压,或者在低温条件下电泳(冰盒、电泳槽加冰袋)。

9V/cm电压下不同电泳时间对比
4. 实验常用电压范围
-
常规琼脂糖凝胶(0.7–2%):4–10 V/cm(电压与电泳槽两电极间距离有关)。
-
小片段 DNA 分离(几十到几百 bp):可稍高电压(8–10 V/cm)。
-
大片段 DNA(>10 kb):应低电压(3–5 V/cm),防止扩散和分辨率丢失。
电压越高,电泳越快,但分辨率和凝胶完整性可能受影响;低电压迁移慢,却能获得更清晰、更可靠的分离效果。
👉 推荐 5–10 V/cm,电极间距 20 cm 时,电压保持在 100–200 V 之间。
🚩 常见误区三:只靠上样染料定位

上样缓冲液是DNA电泳中不可或缺的组成部分,它通常含有两种主要成分:
- 惰性染料(如溴酚蓝、二甲苯青):用于实时监控电泳进程。
- 增稠剂(如甘油、蔗糖、Ficoll):增加样品密度,确保样品沉入加样孔底部。

染料在电泳中起到了“视觉参考线”或“前锋”的作用,其定位功能主要体现在:
- 指示电泳进程,统一上样基准。
- 预估DNA片段的迁移位置:
- 不同的染料在不同浓度的琼脂糖凝胶中,其迁移行为与特定大小的DNA片段相似。因此,它们可以用来粗略估计未知DNA条带的大小。
- 溴酚蓝(Blue:在0.8%-1.0%的琼脂糖凝胶中,其迁移速度大约与300-500 bp的DNA片段相当。
- 二甲苯青(Blue:在0.8%-1.0%的琼脂糖凝胶中,其迁移速度大约与4000-5000 bp的DNA片段相当。
- 例如: 如果你看到溴酚蓝条带快跑出凝胶了,你就知道所有小于500 bp的DNA片段可能已经接近凝胶底部,即将跑出。
👉 不能凭染料位置判断片段大小,这也是为什么 DNA Marker 在电泳中不可或缺。
🚩 常见误区四:Marker 随便用
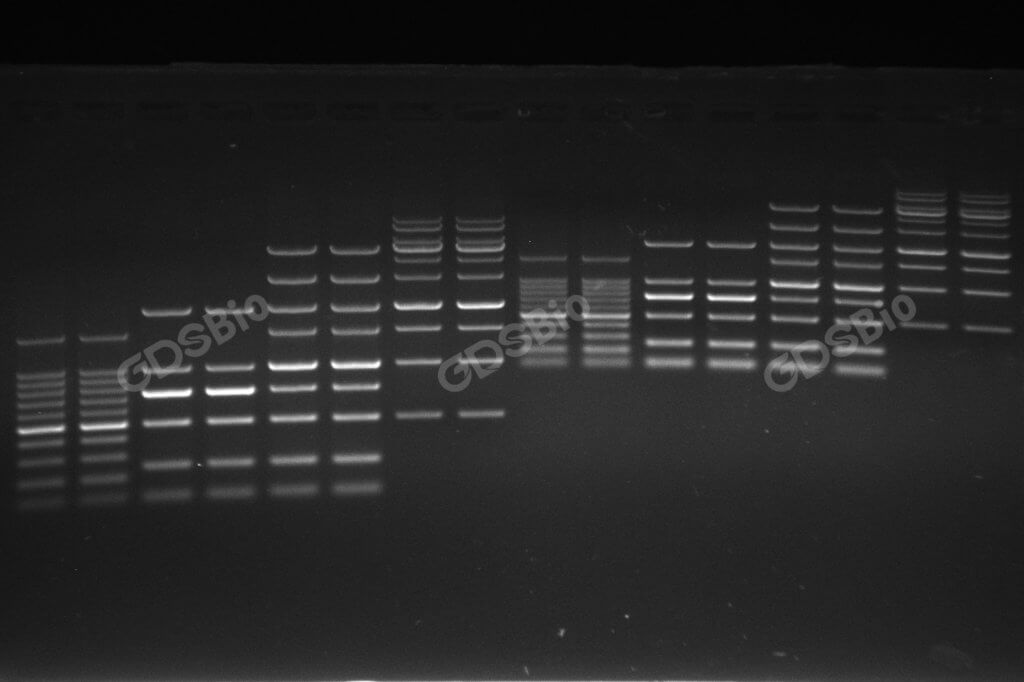
低质量或不匹配Marker带来的三大问题:
- 片段分布稀疏:导致大小判断“失准”
- 问题: 当Marker的条带间隔过大,或恰好在你目标片段的关键区域缺少条带时,你无法进行精确的插值估算。例如,如果你的PCR产物在750 bp左右,而Marker仅在500 bp和1000 bp有条带,你只能模糊地估计产物大小在“500到1000 bp之间”,无法得出准确结论。
- 后果: 实验数据的精确度大打折扣,无法满足克隆鉴定、酶切验证等对大小要求严格的实验需求。
- 条带模糊拖尾:影响结果呈现与可信度
- 问题: 由于保存不当、反复冻融或生产工艺问题,Marker条带可能出现扩散、模糊或强度不均(有的亮有的暗)。这不仅影响观察,更严重影响成像质量。
- 后果: 在论文、报告或展示中,模糊的Marker会让整个实验结果显得不专业、不可靠,降低数据的可信度。审稿人或同行可能会因此质疑你的实验严谨性。
- 缺少关键指示条带:降低实验效率
- 问题: 许多高效能的Marker会在500 bp、1000 bp、1500 bp和2000 bp等关键位置设置特别亮、特别粗的“指示条带”或“参考条带”。
- 后果: 缺少这些指示条带,你在快速浏览凝胶时就无法瞬间定位。你需要花费额外的时间去数条带、比对大小,大大降低了实验分析的效率。尤其在处理多个样品时,这种效率损失尤为明显。
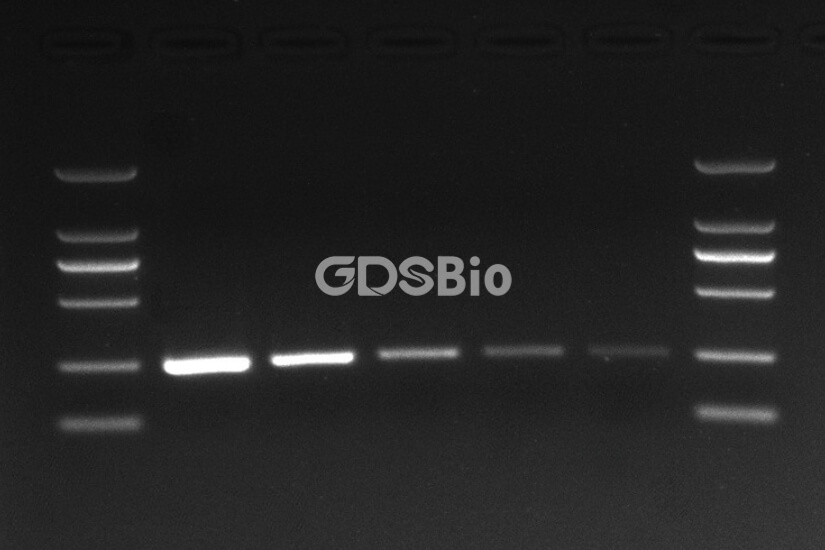
如何选择一个“合理”的Marker?
一个优秀的Marker不应只是DNA片段的简单集合,而应是一个精心设计的测量工具。以下是选择标准:
👉 1. 覆盖合适的片段范围
这是最基本的要求。选择的Marker其条带范围必须将你的目标DNA片段“包围”在中间,而不是落在两端。例如:
- 常规PCR产物鉴定(100 bp - 2 kb): 选择范围覆盖100 bp至2000 bp的Ladder,如著名的100 bp Plus Ladder或1 kb Plus Ladder。
- 大片段酶切或基因组DNA分析(>5 kb): 应选择λ DNA HindIII digest等大片段Marker。
- 小片段 miRNA/siRNA 分析(<100 bp): 需要专门的低分子量Marker。
👉 2. 条带清晰、浓度均一
- 清晰锐利: 每条带都应边界清晰,无拖尾或扩散现象,这表明生产工艺好且保存得当。
- 亮度均一: 理想状态下,所有条带应具有相近的亮度(即DNA含量一致),这确保了不同大小的条带都能被清晰成像,不会出现小条带看不见、大条带又过曝的情况。
👉 3. 含有突出的指示条带,便于快速定位
- 这是区分“优秀”Marker和“普通”Marker的关键。许多高端Marker会特意将500 bp和1000 bp(有时还包括1500 bp和2000 bp)的条带做得更浓、更亮。
- 好处: 在紫外灯下,你的眼睛能立刻抓住这几个“地标”,瞬间建立起凝胶的空间距离与分子大小的对应关系,无需仔细数格子,极大提升了判读效率。
🚩 常见误区五:忽略缓冲液与染料差异
在琼脂糖凝胶电泳中,新手往往将全部注意力集中在琼脂糖浓度和电压设置上,而忽略了两个同样至关重要的因素:电泳缓冲体系和核酸染料。它们并非“通用”的试剂,其选择直接影响DNA的迁移率、条带分辨率和实验安全性,错误的选择会悄然破坏你的实验结果。

一、电泳缓冲液:不仅仅是导电的溶液
最常用的缓冲液是TAE和TBE,它们化学成分不同,决定了其特性和适用场景截然不同。
👉 如何选择?
- 首选TAE的情况: 进行大片段DNA分离(如基因组DNA酶切)、DNA胶回收(兼容性更好)或需要快速电泳时。
- 首选TBE的情况: 进行小片段DNA分离(如PCR产物、SSR分析)、高分辨率电泳(如区分相差几十bp的条带)或需要长时间电泳时。
⚠️ 重要提示:绝对不可将TAE和TBE缓冲液或其浓缩母液混用! 这会导致pH和离子强度异常,产生不可预测的迁移结果。
二、核酸染料:安全与效能的权衡
染料的选择关乎实验结果的清晰度和操作者的生命安全。
👉 如何选择?
- 追求成本与灵敏度: 可能仍在用EB染料,但必须配备严格的防护和废物处理流程。
- 追求安全与便捷(现代实验室首选):AIE-Gelgreen或GelRed是更安全的选择,尤其适合教学实验室或没有专门EB处理设施的实验室。它们通常与蓝光成像系统配套,能最大程度减少对DNA的损伤(UV会使DNA产生嘧啶二聚体,影响下游实验)。
- 注意: 如果实验下游需要进行胶回收克隆,建议选择对酶活影响更小的染料。
总结与实验设计指南
忽略缓冲液和染料的选择,就像用错误的尺子和昏暗的灯光去测量一个精细的零件。
👉 在设计实验时,请遵循这个流程进行选择:
- 看片段大小:
- 看实验目的:
- 常规鉴定 → 可选择性价比高的方案(如DSView染料、EB染料)。
- 胶回收 → 优先选TAE + 对酶活无抑制的染料(如AIE-Gelgreen)。
- 发表级高清图片 → 优先选高分辨率缓冲液(TBE) + 高灵敏度/低背景的染料(如AIE-Gelgreen)。
AIE-Gelgreen核酸凝胶染料
- 看安全性与成本:
- 安全绝对优先 → 毫不犹豫地选择AIE-Gelgreen等安全染料和蓝光成像系统,即使成本稍高。
- 权衡迁移准确性 → 如果担心某些染料影响迁移,可在Marker和样品中使用完全相同的上样缓冲液和染料负载,以消除误差。
因此,将缓冲液和染料视为与凝胶浓度、电压同等重要的核心实验参数,根据你的具体需求进行理性选择,是获得可靠、美观、安全实验结果的必备步骤。
✅ 小结
DNA 电泳看似“基础”,却暗藏不少原理性细节。掌握浓度、电压、缓冲液、Marker 与染料的选择规律,才能保证结果:
-
条带清晰
-
分辨率高
-
实验可重复、可展示
📌 东盛生物提供 高质量 DNA Marker、核酸染料、电泳缓冲液、上样缓冲液、琼脂糖等试剂,助力科研人员高效、稳定地完成核酸电泳工作。
东盛生物DNA Marker (点击图片查看详情)

AIE-Gelgreen核酸凝胶染料 (点击图片查看详情)
订购咨询
广州东盛生物科技有限公司
📧 sales@gdsbio.com
📞 020-87791356
🌐 www.gdsbio.cn